Cartouches SUPAPORE VPP

 Les cartouches SUPAPORE VPP à membrane plissée hydrophile en polyéthersulfone hautement asymétrique ont été développées pour la filtration stérilisante validée des fluides liquides dans les domaines critiques de la santé et des industries pharmaceutique, agro-alimentaire et cosmétique. Les membranes double couches SUPAPORE VPP validées* selon le Standard ASTM F838-83 réapprouvé en 1993 (Challenge Bactérien) sont donc tout particulièrement indiquées pour la filtration finale stérilisante au point d’utilisation et après osmoseur.
Les cartouches SUPAPORE VPP à membrane plissée hydrophile en polyéthersulfone hautement asymétrique ont été développées pour la filtration stérilisante validée des fluides liquides dans les domaines critiques de la santé et des industries pharmaceutique, agro-alimentaire et cosmétique. Les membranes double couches SUPAPORE VPP validées* selon le Standard ASTM F838-83 réapprouvé en 1993 (Challenge Bactérien) sont donc tout particulièrement indiquées pour la filtration finale stérilisante au point d’utilisation et après osmoseur.
Assemblage en salle à environnement contrôlé (salle blanche) sous contrôle strict avec numéro de lot assurant la traçabilité des composants.
Matériaux de construction chimiquement et biologiquement inertes
Conforme aux directives de la FDA (Food & Drug Administration), de
l’USP (Pharmacopée Américaine) et de la CEE
Rinçage à l’eau ultra pure avec retour rapide à une résistivité de 18MΩ
Intégrité des cartouches testée en usine avant leur commercialisation
Rendement et débit élevé, faible perte de charge initiale
Fabrication sans surfactants, liants ou adhésif : soudure US et thermique
Large compatibilité chimique
Applications
Filtration stérilisante validée au point d’utilisation
Filtration stérilisante validée sur départ et retour de boucles après osmoseur
Réduction bactérienne pour applications critiques de traitement de l’eau
Purification de l’eau au point d’utilisation et au niveau du process
Matériaux de construction
Média filtrant : Polyéthersulfone (PES), membrane plissée double couche
Support et drainage : Polypropylène (PP), couche de préfiltration assurant une meilleure mouillabilité
Armature, embouts et cage : Polypropylène
Sécurité biologique
Les matériaux de construction des cartouches SUPAPORE VPP sont en conformité avec les exigences des Directives Européennes – CFR Titre 21 pour les matériaux destinés à un contact alimentaire.
Les cartouches SUPAPORE VPP satisfont aux spécifications de l’USP pour les plastiques de Classe VI-121°C concernant les substances extractibles.
Leur effluent est apyrogène (niveau d’endotoxines bactériennes ≤ 0,25 EU/mL, selon la méthodologie de test LAL).
Caractéristiques techniques
Seuils de rétention absolu : 0,1μm – 0,2μm – 0,45μm – 0,65μm
T°C max d’utilisation continu : 80°C
Dimensions : Diamètre extérieur 70mm, intérieur 31mm
Surface filtrante : 0,55 à 0,65m2 pour 10″
Stérilisation** : Autoclave ou vapeur en ligne à 135°C pendant 30mn (40 cycles)
Stérilisation** : Chimique avec agent compatible ou à l’eau chaude jusqu’à 95°C pendant 30mn (∆P max = 0,2 Bar)
Pertes de charge recommandée pour remplacement : 2 Bar à 20°C
Pression différentielle maximum recommandée : 5 Bar à 20°C.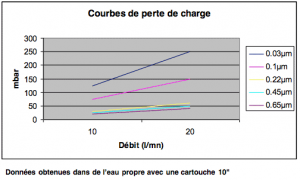
Tests d’intégrité
| Seuil de filtration absolu | Point de bulle dans l’eau | Débit de diffusion dans l’eau |
| 0,1μm | 4140mBar (60psi) | ≤ 15mL/minute @ 3310mBar (48psi) |
| 0,2μm | 3030mBar (44psi) | ≤ 15mL/minute @ 2410mBar (35psi) |
| 0,45μm | 1720mBar (25psi) | ≤ 15mL/minute @ 1380mBar (20psi) |
| 0,65μm | 1310mBar (19psi) | ≤ 15mL/minute @ 1030mBar (15psi) |
Tests réalisés sur une cartouche de 10″ avec de l’eau déminéralisée.
Challenge Bactérien
0,2μm 1010 [Brevundimonas Diminuta (ATCC19146)]
0,45μm 1010 [Serratia Marcescens (ATCC 14756)]
0,65μm 1010 [Saccharomyces Cerevisiae]
* Guide de validation complet fourni sur demande.
** Avec embouts renforcés pour les codes 2, 3 et 7 : “G” en terminaison de code cartouche.
